jueves, 15 de diciembre de 2016
máquina térmica
Una máquina térmica es un dipositivo cuyo objetivo es convertir calor en trabajo. Para ello utiliza de una sustancia de trabajo (vapor de agua, aire, gasolina) que realiza una serie de transformaciones termodinámicas de forma cíclica, para que la máquina pueda funcionar de forma continua. A través de dichas transformaciones la sustancia absorbe calor (normalmente, de un foco térmico) que transforma en trabajo.
El desarrollo de la Termodinámica y más en concreto del Segundo Principio vino motivado por la necesidad de aumentar la cantidad de trabajo producido para una determinada cantidad de calor absorbido. De forma empírica, se llega así al primer enunciado del Segundo Principio:
Enunciado de Kelvin-Planck
No es posible ninguna transformación cíclica que transforme íntegramente el calor absorbido en trabajo.
|
Este enunciado implica que la cantidad de energía que no ha podido ser transformada en trabajo debe cederse en forma de calor a otro foco térmico, es decir, una máquina debe trabajar al menos entre dos focos térmicos. El esquema más sencillo de funcionamiento es entonces el siguiente:

- Absorbe una cantidad de calor Q1 de un foco caliente a una temperatura T1
- Produce una cantidad de trabajo W
- Cede una cantidad de calor Q2 a un foco frío a una temperatura T2
Como la máquina debe trabajar en ciclos, la variación de energía interna es nula. Aplicando el Primer Principio el trabajo producido se puede expresar:


En general, se define Potencia (P) como el trabajo dividido por el tiempo, en caso de las máquinas corresponde entonces al trabajo producido en un segundo. En el S.I. de Unidades se mide en Watios (J/s)

Rendimiento (η)
El objetivo de una máquina es aumentar la relación entre el trabajo producido y el calor absorbido; se define pues el rendimiento como el cociente entre ambos. Si tenemos en cuenta la limitación impuesta por enunciado de Kelvin-Planck, el trabajo es siempre menor que el calor absorbido con lo que el rendimiento siempre será menor que uno:
 |  |
Habitualmente se expresa el rendimiento en porcentaje, multiplicando el valor anterior por cien. Para las máquinas más comunes este rendimiento se encuentra en torno al 20%.
Usando la expresión anterior del trabajo, el rendimiento se puede calcular también como:

Equilibrio térmico
EQUILIBRIO TÉRMICO
Si en el universo se alcanzara el equilibrio y existiera en todos los lugares la misma temperatura eso supondría la muerte, la quietud, la falta de cambio.

Todos los cuerpos tienen una energía llamada energía interna. La cantidad de energía interna de un cuerpo es muy difícil de establecer ya que las partículas que forman un cuerpo tienen energías muy variadas. Tienen energías de tipo eléctrico, de rotación, de traslación y vibración debido a los movimientos que poseen, energías de enlace (que pueden dar posibles reacciones químicas) e incluso energía al desaparecer la materia y transformarse en energía DE=mc2 ....
Lo más fácil de medir es la variación de energía en un proceso de transformación concreto y si el proceso es sólo físico mucho mejor. (Ejemplos: calentamiento, cambios de estado...).
Al poner en contacto dos cuerpos a distinta temperatura, el de mayor temperatura cede parte de su energía al de menos temperatura hasta que sus temperaturas se igualan. Se alcanza así lo que llamamos"equilibrio térmico".
La energía calorífica (calor) no pasa del cuerpo que tiene más energía al que tiene menos sino del que tiene mayor temperatura al que la tiene menor.
Con el siguiente ejemplo aclaramos la anterior afirmación:
 Pulsa para ver foto ampliada del iceberg Pulsa para ver foto ampliada del iceberg |
Los mares (los océanos están intercomunicados) pueden ceder mucha más energía calorífica que mi cuerpo. El mar es capaz de fundir un iceberg y sus aguas apenas se enfrían unos grados. Yo, con el calor que puedo desprender en todos los días de mi vida (parte de las 2.100.000 calorías que consumo al día) fundiría muy pocas toneladas de iceberg.
Puede ceder mucho más calor el mar que mi cuerpo.
Pero si me sumerjo en el agua de mar el calor pasa de mi cuerpo al mar.
|
El calor fluye desde los cuerpos que están a más temperatura a los que están a temperatura menor.

Vamos a comprobarlo
Calentamos en un tubo de ensayo 25 ml H2O (agua) hasta una temperatura alta. Lo introducimos centrado en un vaso de precipitados mas grande que contiene 100 ml de agua. Medimos las temperaturas de los dos a intervalos de un minuto.
Agitamos el tubo de ensayo para homogeneizar la temperatura dentro y fuera y mantenemos la sonda externa alejada del tubo de ensayo.
Registramos los datos, los anotamos en una tabla y registramos gráficamente las temperaturas de cada uno frente al tiempo.
En nuestro caso el registro lo hizo el aparato electrónico y la gráfica nos la dio el mismo aparato, pero disponiendo de dos termómetros podemos anotar los datos y luego hacer la gráfica.
Los recursos electrónicos nos permiten hacer más rápidas y más bonitas las gráficas, pero los conceptos que se descubren se pueden obtener igualmente aunque no dispongamos de tantos recursos.

¿Puedes saber la temperatura inicial del foco caliente viendo la gráfica? ¿Y del foco frío?. ¿Cuál fue la temperatura final?
¿Cuánto tardaron en igualarse las temperaturas?
En el punto en que se igualan las T el foco frío queda momentáneamente a una temperatura inferior debido a un error de lectura experimental. Una agitación continuada de los dos líquidos en contacto las igualará.
Si dejamos el sistema abandonado las temperaturas del agua del tubo y del vaso continuarán iguales y empezarán a descender al mismo tiempo, porque los alrededores están a menor temperatura.
Las pendientes de las curvas obtenidas en los registros de las temperaturas hacia el equilibrio dependen de las masa y de los calores específicos de las sustancias puestas en contacto.
 | Si la curva de enfriamiento y la de calentamiento tienen la misma pendiente (una creciente y la otra decreciente) ¿qué puedes deducir? ¿Estará relacionado con que la masa del líquido caliente es igual a la del frío y se trata de la mismas sustancia? |
Cambios de estado
En física y química se denomina cambio de estado a la evolución de la materia entre varios estados de agregación sin que ocurra un cambio en su composición. Los tres estados más estudiados y comunes en la Tierra son el sólido, el líquido y el gaseoso; no obstante, el estado de agregación más común en el Universo es el plasma, material del que están compuestas las estrellas (si se descarta la materia oscura).
Tipos de cambio de estado[editar]
Son los procesos en los que un estado de la materia cambia a otro manteniendo una semejanza en su composición. A continuación se describen los diferentes cambios de estado o transformaciones de fase de la materia:
- Fusión: Es el paso de un sólido al estado líquido por medio del calor; durante este proceso endotérmico (proceso que absorbe energía para llevarse a cabo este cambio) hay un punto en que la temperatura permanece constante. El "punto de fusión" es la temperatura a la cual el sólido se funde, por lo que su valor es particular para cada sustancia. Dichas moléculas se moverán en una forma independiente, transformándose en un líquido. Un ejemplo podría ser un hielo derritiéndose, pues pasa de estado sólido al líquido.
- Solidificación: Es el paso de un líquido a sólido por medio del enfriamiento; el proceso es exotérmico. El "punto de solidificación" o de congelación es la temperatura a la cual el líquido se solidifica y permanece constante durante el cambio, y coincide con el punto de fusión si se realiza de forma lenta (reversible); su valor es también específico.
- Vaporización y ebullición: Son los procesos físicos en los que un líquido pasa a estado gaseoso. Si se realiza cuando la temperatura de la totalidad del líquido iguala al punto de ebullición del líquido a esa presión continuar calentándose el líquido, éste absorbe el calor, pero sin aumentar la temperatura: el calor se emplea en la conversión del agua en estado líquido en agua en estado gaseoso, hasta que la totalidad de la masa pasa al estado gaseoso. En ese momento es posible aumentar la temperatura del gas.
- Condensación: Se denomina condensación al cambio de estado de la materia que se pasa de forma gaseosa a forma líquida. Es el proceso inverso a la vaporización. Si se produce un paso de estado gaseoso a estado sólido de manera directa, el proceso es llamado sublimación inversa. Si se produce un paso del estado líquido a sólido se denomina solidificación.
- Sublimación: Es el proceso que consiste en el cambio de estado de la materia sólida al estado gaseoso sin pasar por el estado líquido. Un ejemplo clásico de sustancia capaz de sublimarse es el hielo seco.
- Sublimación inversa: Es el paso directo del estado gaseoso al estado sólido.
- Desionización: Es el cambio de un plasma a gas.
- Ionización: Es el cambio de un gas a un plasma.
Tipos de procesos termodinámicos
Procesos termodinámicos que se dan con frecuencia en situaciones prácticas, los cuales son:
- Proceso Adiabático: Es uno en el que no entra ni sale calor del sistema; Q=0. Podemos evitar el flujo de calor ya sea rodeando el sistema con material térmicamente aislante o realizando el proceso con tal rapidez que no haya tiempo para un flujo de calor apreciable. Por la primera ley, para todo proceso adiabático,
Cuando un sistema se expande adiabáticamente, W es positivo (el sistema efectúa trabajo sobre su entorno), así que es negativo y la energía interna disminuye, y cuando se comprime adiabáticamente es todo lo contrario.
- Proceso Isocórico: Se efectúa a volumen constante. Si el volumen de un sistema termodinámico es constante, no se realiza trabajo sobre su entorno; W=0 y
En un proceso isocórico, toda la energía agregada como calor permanece en el sistema como aumento de energía interna.
- Proceso Isobárico: Se efectúa a presión constante. En general, ninguna de las tres cantidades: es cero en un proceso isobárico, pero aun así es fácil calcular W, entonces se tiene
- Proceso Isotérmico: Se efectúa a temperatura constante. Para ello, todo intercambio de calor con el entorno debe efectuarse con tal lentitud para que se mantenga en equilibrio térmico.
La energía interna de un sistema depende únicamente de su temperatura, no de su presión ni su volumen. El sistema mas conocido que posee esta propiedad especial es el gas ideal. En tales sistemas, si la temperatura es constante, la energía interna también lo es; ΔU=0 y Q=W. Es decir, toda la energía que entre en el sistema como calor Q debería salir como trabajo W efectuado por el sistema.
- Proceso Politrópicos: Es un proceso interiormente reversible durante el cual;
donde n es una constante. Debido a que pVn=C y pVk=C son iguales.
PROCESOS TERMODINAMICOS
En física, se denomina proceso termodinámico a la evolución de determinadas magnitudes (o propiedades) propiamente termodinámicas relativas a un determinado sistema termodinámico. Desde el punto de vista de la termodinámica, estas transformaciones deben transcurrir desde un estado de equilibrio inicial a otro final; es decir, que las magnitudes que sufren una variación al pasar de un estado a otro deben estar perfectamente definidas en dichos estados inicial y final. De esta forma los procesos termodinámicos pueden ser interpretados como el resultado de la interacción de un sistema con otro tras ser eliminada alguna ligadura entre ellos, de forma que finalmente los sistemas se encuentren en equilibrio (mecánico, térmico y/o material) entre sí.
De una manera menos abstracta, un proceso termodinámico puede ser visto como los cambios de un sistema, desde unas condiciones iniciales hasta otras condiciones finales, debido a su desestabilización.
FORMAS DE PROGRAMACIÓN DEL CALOR
-Conducción
Esta forma de propagación se da en los sólidos, cuando se aplica calor a un objeto sólido, la zona donde absorbe calor se calienta y sus partículas adquieren mayor movilidad que el resto del cuerpo y cada partícula transmite el calor a las partículas vecinas, con el cual el calor acaba por propagarse por todo el objeto.
Ejemplos:
- Utensilios metálicos para cocinar, como por ejemplo una olla de acero. Esta recibe el calor en la base y luego se propaga por toda la olla. Es por ello que las asas tienen que ser de un material aislante como madera o plástico, para no sufrir quemaduras.
- Tenemos un vaso de leche que está muy caliente. En su interior se introduce una cuchara. Al pasar un rato, si se toca la cuchara que se encuentra en su interior, se nota que se va calentando cada vez más. Esta transferencia de calor se ha producido desde una sustancia, que es la leche hasta un cuerpo que es la cuchara.
2.-Convección
La propagación del calor por convección se da en los líquidos y en los gases. Es decir cuando calentamos un líquido o un gas en un recipiente, las primeras partículas en calentarse son las del fondo, por la que parte del líquido o del gas del fondo se dilata y disminuye su densidad y al ocurrir esto esta parte del líquido o gas asciende por el recipiente y la parte del líquido o gas que estaba encima baja para ocupar el espacio dejado, originándose las llamadas corrientes de convección que van calentando todas las sustancias del recipiente.
Ejemplos :
- El aire por convección origina los vientos.
- Si se coloca una espiral de cartulina, en un soporte universal y se sopla desde abajo hacia arriba se puede apreciar cómo esta comienza a girar alrededor del punto donde se apoya. También si se coloca una vela encendida o cualquier otra fuente de calor debajo del espiral, esta gira porque el aire que se calienta, asciende y esto se demuestra porque se pone en movimiento la espiral, igual que cuando se soplaba desde abajo hacia arriba. Por tanto, se producen corrientes de aire caliente que suben y de aire frío que baja.
3.-Radiación
La radiación es la propagación del calor que tiene lugar sin el apoyo del ningún medio material.
Ejemplos:
- Los radiadores
- Las aguas de la superficie del mar reciben la radiación del sol por eso logran evaporarse.
- Los panaderos, cuando van a sacar el pan del horno, están recibiendo el calor procedente de este, por radiación.
- Los obreros metalúrgicos reciben mucho calor procedente de los altos hornos en que se funden los metales y ese calor les llega por radiación.
- En sus hogares, cuando la mamá está cocinando, recibe por radiación el calor procedente de la cocina, puesto que no está situada encima de la fuente de calor, ni en contacto directo con ella, sino delante de las hornillas.
CALOR
Calor es el proceso de intercambio de energía térmica que se transfiere entre dos sistemas (o un sistema y sus alrededores) debido a una diferencia de temperatura.1 También se denomina calor a la energía en tránsito que se reconoce solo cuando se cruza la frontera de un sistema termodinámico. Una vez dentro del sistema, o en los alrededores, si la transferencia es de dentro hacia afuera, el calor transferido se vuelve parte de la energía interna del sistema o de los alrededores, según su caso. El término calor, por tanto, se debe de entender como transferencia de calor y solo ocurre cuando hay diferencia de temperatura y en dirección de mayor a menor. De ello se deduce que no hay transferencia de calor entre dos sistemas que se encuentran a la misma temperatura (están en equilibrio térmico).
lunes, 7 de noviembre de 2016
Ejercicios de Dilatación
1.- Los rieles de una vía de tren de acero, tienen 1500 m de longitud . ¿Qué longitud tendrá cuando la temperatura aumente de 24°C a 45°C?
Solución: El problema es muy sencillo, por lo cual no requiere mucho análisis, sin embargo vamos a tocar ese punto antes de comenzar a resolverlo.
Si bien se sabe, los rieles en las vías del ferrocarril, normalmente se le coloca un espacio entre ellas a cierta distancia para cuando éste material se dilate a ciertas horas del día.
Ahora anotemos nuestros datos:
Datos:
Hemos elegido acero, porque el problema nos pide que son vías del ferrocarril de acero.
Lo único que haremos será sustituir nuestros datos, en la fórmula final.
Pero antes de sustituir, debemos saber cual es el valor de la diferencial de temperatura, para poder meterla en la fórmula, esa diferencial es la resta de la temperatura más alta, con la temperatura más baja.
Ahora si, a sustituir en la fórmula.
Si observamos, las vías del tren se han dilatado solo .3465 metros, es decir 346.5 milimetros, muy poco, pero significativo para la distancia entre las juntas de riel.
Ahora veamos otro ejemplo 

2.- En un experimento en laboratorio los ingenieros quieren saber la temperatura en la que un cuerpo de plomo alcanza los 25.43 m de longitud, cuando inicialmente se mantiene 25.34 m a una temperatura de 26°C.
Solución: El problema nos pide la temperatura final de un cuerpo de plomo cuando éste alcanza una longitud final de 25.43, para ello vamos a considerar primeramente nuestros datos:
Ahora solamente tenemos que despejar nuestra fórmula en términos de la temperatura final.
Ahora tenemos que invertir la ecuación, para mayor comodidad
Posteriormente si sabemos que 
Entonces
Despejando la temperatura final:
Ahora reemplazamos nuestros datos:
Por lo que tenemos una temperatura final de 148.4772°C
Y eso nos da a entender que justamente cuando el cuerpo alcanza cierta dilatación final de 25.34m, lo hace cuando la temperatura está a los 148.4772°C
TIPOS DE DILATACION
La dilatación térmica es el proceso por el cual los cuerpos aumentan su volumen debido a su temperatura. Afecta a todos los estados de agregación de la materia. En este apartado veremos:
- El concepto de dilatación y contracción térmica
- La dilatación en los sólidos
- La dilatación en los líquidos
- La dilatación en los gases
¿Por qué se dilatan los cuerpos?
Cuando un cuerpo aumenta su temperatura, las partículas se mueven más deprisa, por lo que necesitan más espacio para desplazarse. Es por ello que el cuerpo necesita aumentar su volumen.
La dilatación térmica es el proceso por el cual los cuerpos aumentan su volumen cuando se aumenta su temperatura.
Cuando en lugar de aumentar, la temperatura disminuye, el volumen del cuerpo también lo hace, hablándose en estos casos de contracción térmica.
Estos fenómenos son especialmente importantes a la hora de fabricar determinadas estructuras como por ejemplo las vías de tren. Las industrias que fabrican los rieles los entregan con una longitud de unos 12 m. Es necesario unirlos (generalmente abulonados) para formar las vías. Durante el día la temperatura ambiente que pueden llegar a soportar ronda entorno a los 40° e incluso el acero puede alcanzar una temperatura muy superior. Dicha temperatura provoca dilataciones en las vías favoreciendo que en las uniones se provoquen deformaciones. Por esta razón, justamente en dichas uniones se deja una separación de unos 5 mm denominado junta de dilatación.

El problema de esta separación es que es incompatible con el desplazamiento de los trenes de alta velocidad (250 km/h) ya que generan mucho ruido al circular el tren por ellas y las ruedas y rieles sufrirían roturas. La tecnología moderna ha logrado soldaduras especiales que absorben las dilataciones, por lo tanto hay tramos de muchos kilómetros (varias decenas) sin separaciones aunque en las cercanías de las estaciones de ferrocarril se siguen utilizando ya que por esas zonas los trenes deben disminuir mucho su velocidad.
Dilatación de sólidos
De entre los estados de agregación de la materia estudiados, el estado sólido es el que tiene las fuerzas de cohesión más fuertes, por lo que resulta más dificil observar la dilatación que en líquidos y gases. En función del número de dimensiones que predominan en el cuerpo, podemos distinguir tres casos:
Dilatación lineal
Se produce cuando predomina una dimensión frente a las otras dos. Ejemplos de cuerpos que se dilatan linealmente son: varillas, alhambres, barras...
La dilatación lineal de un cuerpo viene dada por la expresión:
Donde:
- l, l0 : Longitud final e inicial respectivamente del cuerpo. Su unidad de medida en el Sistema Internacional es el metro ( m )
- λ: Coeficiente de dilatación lineal. Es específico de cada material y representa el alargamiento que experimenta la unidad de longitud de un sólido, cuando su temperatura se eleva 1 K. Su unidad de medida en el Sistema Internacional es el K-1, aunque también se usa el ºC-1
- ∆T: Incremento de temperatura que experimenta el cuerpo. Su unidad de medida en el Sistema Internacional es el kelvin ( K ), aunque también se usa el ºC
Observa que, aunque la unidad de temperatura en el Sistema Internacional es el kelvin, por comodidad también se usa el ºC, en cuyo caso el coeficiente de dilatación lineal λ se expresa en ºC-1, aunque su valor es el mismo

Valores típicos del coeficiente de dilatación
El coeficiente de dilatación en el caso de los líquidos suele mantenerse constante para cambios de temperatura ∆T menores de 100 grados. Algunos valores típicos para el coeficiente de dilatación lineal son:
| Material | Coeficiente dilatación lineal λ ( K-1 o ºC-1 ) |
|---|---|
| Plata | 3·10-5 |
| Plomo | 2.9·10-5 |
| Zinc | 2.6·10-5 |
| Aluminio | 2.4·10-5 |
| Cobre | 1.7·10-5 |
| Oro | 1.5·10-5 |
| Vidrio | 0.9·10-5 |
| Diamante | 0.12·10-5 |
| Cuarzo | 0.04·10-5 |
Dilatación superficial
Se produce cuando predominan dos dimensiones (una superficie) frente a una tercera. Ejemplos de cuerpos que se dilatan superficialmente son: láminas, planchas...
La dilatación superficial de un cuerpo viene dada por la expresión:
Donde:
- S, S0 : Área final e inicial respectivamente del cuerpo. Su unidad de medida en el Sistema Internacional es el metro al cuadrado ( m2 )
- σ: Coeficiente de dilatación superficial. Es específico de cada material y representa el aumento de superficie de un sólido de área unidad, cuando su temperatura se eleva 1 K. Su unidad de medida en el Sistema Internacional es el K-1, aunque también se usa el ºC-1
- ∆T: Incremento de temperatura que experimenta el cuerpo. Su unidad de medida en el Sistema Internacional es el kelvin ( K ) , aunque también se usa el ºC
La relación entre el coeficiente de dilatación lineal λ y el coeficiente de dilatación superficial σ es σ=2⋅λ .
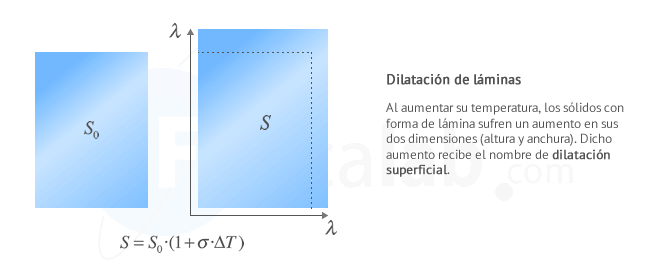
Observa que, aunque la unidad de temperatura en el Sistema Internacional es el kelvin, por comodidad también se usa el ºC, en cuyo caso el coeficiente de dilatación superficial σ se expresa en ºC-1, aunque su valor es el mismo.
Dilatación volumétrica o cúbica
Se produce cuando las tres dimensiones del cuerpo son igualmente relevantes. Ejemplos de cuerpos que se dilatan de modo volumétrico son: los dados del parchís, o las estatuas de los jardines ...
La dilatación volumétrica de un cuerpo viene dada por la expresión:
Donde:
- V, V0 : Volumen final e inicial respectivamente del cuerpo. Su unidad de medida en el Sistema Internacional es el metro al cubo ( m3 )
- γ: Coeficiente de dilatación volumétrica o cúbica. Es específico de cada material y representa el aumento de volumen de un sólido de volumen unidad, cuando su temperatura se eleva 1 K. Su unidad de medida en el Sistema Internacional es el K-1, aunque también se usa el ºC-1
- ∆T: Incremento de temperatura que experimenta el cuerpo. Su unidad de medida en el Sistema Internacional es el kelvin ( K ), aunque también se usa el ºC
La relación entre el coeficiente de dilatanción lineal λ y el coeficiente de dilatación volumétrico γ es γ=3⋅λ
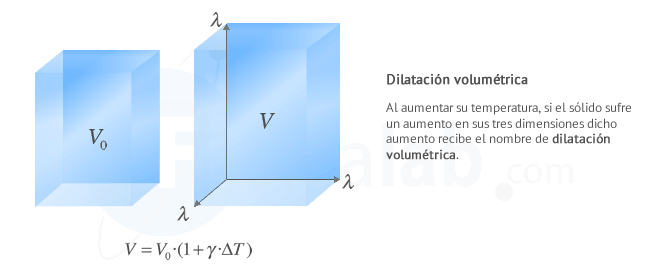
Observa que, aunque la unidad de temperatura en el Sistema Internacional es el kelvin, por comodidad también se usa el ºC, en cuyo caso el coeficiente de dilatación volumétrico γ se expresa en ºC-1, aunque su valor es el mismo.
Ejemplo
Disponemos de un cubo de un material a 24 ºC que ocupa un volumen de 1 m3 . Cuando aumentamos la temperatura a 55 ºC, el volumen del cubo pasa a 1.002232 m3 . Responde a las siguientes preguntas:
- ¿Cual es el coeficiente de dilatación cúbica del material?
- Imagina que, a 24 ºC, cortas varias barras de 1 m de longitud (valor de la arista del cubo). ¿Qué longitud pasarían a tener cuando se eleva la temperatura a 55 ºC?
Dilatación de líquidos
El efecto de la dilatación en los líquidos es más evidente que en los sólidos: al encontrarse sus moléculas con más libertad para moverse, el volumen que ocupa cada una aumenta más facilmente con la temperatura, por lo que también lo hace el volumen del líquido en su conjunto. Su expresión es similar a la dilatación volumétrica de los sólidos.
La dilatación de los líquidos sigue la expresión:
Donde:
- V, V0 : Volumen final e inicial respectivamente del líquido. Su unidad de medida en el Sistema Internacional es el metro al cubo ( m3 )
- α: Coeficiente de dilatación del líquido. Es específico de cada líquido y representa el aumento de volumen de un líquido de volumen la unidad, cuando su temperatura se eleva 1 K. Su unidad de medida en el Sistema Internacional es el K-1, aunque también se usa el ºC-1
- ∆T: Incremento de temperatura que experimenta el líquido. Su unidad de medida en el Sistema Internacional es el kelvin ( K ), aunque también se usa el ºC
Observa que, aunque la unidad de temperatura en el Sistema Internacional es el kelvin K, por comodidad también se usa el grado centígrado ºC, en cuyo caso el coeficiente de dilatación del líquido α se expresa en ºC-1, aunque su valor es el mismo.
Ten muy presente que cuando queremos medir la dilatación en un líquido, hemos de tener en cuenta que el recipiente sólido en el que lo colocamos también se dilata.
Valores típicos del coeficiente de dilatación
El coeficiente de dilatación en el caso de los líquidos suele variar con la temperatura de forma más pronunciada a lo que ocurre en los sólidos. A continuación se recogen algunos valores típicos del coeficiente de dilatación α para líquidos a una temperatura de 20 ºC. Observa que son sensiblemente superiores al caso de los sólidos. Esto implica que la dilatación en los líquidos es más evidente que en los sólidos para un mismo material y un mismo cambio de temperatura.
| Material | Coeficiente dilatación α ( K-1 o ºC-1 ) |
|---|---|
| Mercurio | 18.1·10-4 |
| Alcohol | 14·10-4 |
| Benceno | 11.7·10-4 |
| Glicerina | 5.2·10-4 |
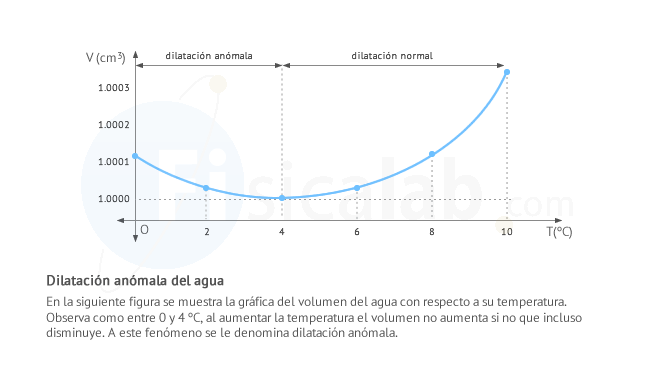
Dilatación anómala del agua
Algunos líquidos se comportan de manera anómala en ciertos intervalos de temperatura y presión, aumentando su volumen cuando disminuye su temperatura y viceversa. Es el caso del agua a 1 atm de presión y en el intervalo de 0 ºC a 4 ºC. Este comportamiento es muy importante para que pueda existir la vida.
Dilatación de gases
El efecto de la dilatación en los gases es el más evidente de todos. Los gases varian de forma clara su volumen tanto con la temperatura como con la presión debido a que las fuerzas de cohesión entre las partículas son más debiles que en los casos anteriores. Su expresión es similar a la dilatación volumétrica de los sólidos.
La dilatación de los gases a presión constante sigue la expresión:
Donde:
- V, V0 : Volumen final e inicial respectivamente del líquido. Su unidad de medida en el Sistema Internacional es el metro al cubo ( m3 )
- αp: Coeficiente de dilatación a presión constante. Para una presión determinada existe un valor de αp , único igual para todos los gases. Su unidad de medida en el Sistema Internacional es el K-1, aunque también se usa el ºC-1
- ∆T: Incremento de temperatura que experimenta el líquido. Su unidad de medida en el Sistema Internacional es el kelvin ( K ), aunque también se usa el ºC
Observa que, aunque la unidad de temperatura en el Sistema Internacional es el kelvín, por comodidad también se usa el ºC, en cuyo caso el coeficiente de dilatación del gas α se expresa en ºC-1, aunque su valor es el mismo.
Observa también que el coeficiente de dilatación αp es igual para todos los gases que se encuentran a una determinada presión. Por otro lado, el volumen V de un gas es 0 a una temperatura T de -273 ºC (0 K o cero absoluto). Este comportamiente permite dibujar las siguientes lineas que representan el volumen de cualquier gas a una determinada presión.
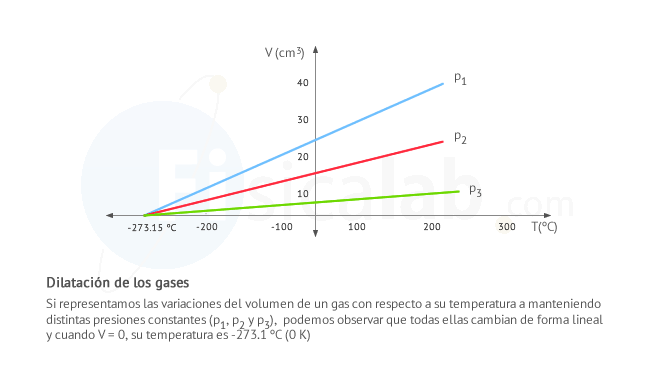
Finalmente, si conoces el volumen inicial del gas a 0 ºC, V0 , el coeficiente de dilatación de cualquier gas viene dado por:
Comprobación
La ecuación general de los gases establece que el producto de la presión P por el volumen V que ocupa el gas se relaciona con la temperatura T según:
Donde n es el número de moles del gas y R es una constante de valor 0.982 atm·L / K·mol.
Si consideramos un gas a presión constante sometido a dos temperaturas T0 y T1 distintas, ocupara dos volúmenes distintos, V0 y V1. Dado que la presión es constante, P1 = P2 = P y podemos escribir:
Por tanto, la diferencia entre ambas expresiones nos permite llegar al resultado buscado:
Finalmente, identificando la expresión anterior con la que habíamos dado para la dilatación volumétrica de los gases, V=V0⋅(1+αp⋅ΔT) tenemos que αp = 1/T0 y, dado que habíamos dicho que T0 = 273.15ºC, αp = 1/273.15 ºC-1.
Suscribirse a:
Comentarios (Atom)





